Питательный раствор - вода, питательные вещества и фильтрация.
Теперь переходим к очень важной главе. По аналогии с миром компьютеров, если гидропонная система и субстрат — это аппаратные средства, то питательный раствор - программное обеспечение. Нам известно, что не все компьютерные программы функционируют равноценно, и одни работают лучше других. К тому же различные задачи требуют различных программ. Вода - хороший носитель питательных веществ для растений, но, как мы увидим, питательный раствор содержит гораздо больше, чем вода и добавки минеральных солей. Но сперва мы поговорим о воде.
Вода
Вода - любопытное вещество, обладающее такими свойствами, каких нет у других веществ. Например, вода - одно из немногих веществ, которое занимает больше места при замерзании, чем в жидком состоянии (вода захватывает пузырьки воздуха). Благодаря этому лед плавает в воде, создавая ледовый покров, защищающий остальную воду от замерзания. Если бы лед тонул, то озера превращались бы в массу сплошного льда до самого дна. Без жидкой воды нет жизни! Все химические реакции, которые мы называем жизнью, происходят в воде. Кто не знает химическую формулу воды – H2O! То есть два атома водорода и один атом кислорода. Молекулы воды находятся в постоянном движении, и атомы водорода связаны с кислородом непрочно, поэтому молекулы воды легко обмениваются своим водородом между собой или с другими веществами. Также из-за большой разницы в размерах между атомами водорода и кислорода образуется угол между атомами водорода, и молекулы воды получают электрический заряд. Благодаря этому, вода вступает в реакции со многими веществами.
Для нас важны такие характеристики воды, как рН, щелочность, жесткость и соленость.
pН-фактор
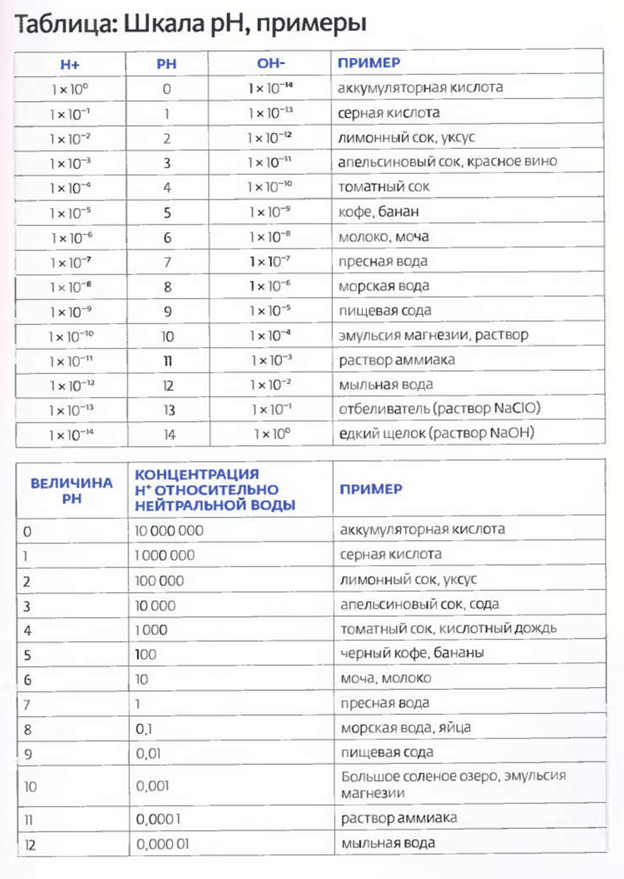
В каждый момент времени незначительное количество молекул воды (2 на 10 миллиардов!) распадаются на две заряженные частицы Н+ ОН- (примечание для ревнителей чистой науки: я знаю, что в действительности дело обстоит несколько сложнее, просто хочу представить данное явление в упрощенном виде). Аббревиатура рН означает Potential hydrogen (потенциальный водород) или сила водорода (отсюда и прописная «р» и заглавная «Н»), рН измеряет относительную концентрацию ионов и ОН- в воде. Чем больше Н+ тем кислотнее вода; чем больше ОН- (меньше Н+), тем вода более щелочная. Шкала рН состоит из 14 единиц (от 0 до 14), где 0 соответствует максимальной кислотности, 7 - нейтральности, а 14 - максимальной щелочности.
Очевидно, что в чистой воде количество ионов Н+ и ОН- уравновешено: это нейтральный рН или рН 7. При увеличении Н+ повышается кислотность, при увеличении ОН- повышается щелочность. Кислота — это соединение, которое выделяет ионы Н+ при растворении. Щелочь в растворе выделяет ионы ОН-. Простые примеры:
- соляная кислота, НСl, распадается на Н+ и Сl- (хлорид);
- каустическая сода, NaОН, распадается на Na+ (натрий) и ОН- (гидроксильная группа).

Если взглянуть на приведенную выше таблицу, то станет понятно, почему шкала имеет 14 делений от 0 до 14. В чистой воде, при нейтральном рН, концентрация Н+ составляет 1х10-7 на 1 литр. Теперь понятно откуда взялась семерка? Фактически число рН указывает на концентрацию ионов Н+ в растворе. При рН 6,1 х 10-6 и т.д. Берется экспонента, отбрасывается знак минус, и вы получаете величину рН. Одной важной отличительной чертой шкалы, которая имеет для нас практическое значение, является то, что она представляет собой логарифмическую шкалу. А с чем её едят? Все просто - на каждой ступени шкала возрастает или убывает на один порядок. Например, при рН 6 ионов Н+ в 10 раз больше, чем при рН 7. При рН 5 ионов Н+ в 100 раз больше, чем при рН 7 и т.д. И, напротив, при рН 8 ионов ОН- будет в 10 раз больше, чем при рН 7. При рН 9 ионов ОН- будет в 100 больше, чем при рН 7 и в 10 раз больше, чем при рН 8).

В повседневной жизни вам, возможно, это уже встречалось. Скажем, кислотность воды слишком велика, около 4 единиц: при таком рН у вас в 1 миллион раз больше ионов Н+ чем ионов ОН-. Очевидно, придется добавить много щелочи, прежде чем рН начнет повышаться. Но когда рН дойдет до б единиц, то ионов Н+ будет всего в 100 раз больше, но малого количества щелочи хватит надолго! Поэтому зачастую при корректировке рН начинающие переходят искомую черту. Чем ближе подходишь к 7, тем меньше кислоты или щелочи нужно для корректировки рН, и нужно мало ионов Н+ или ОН-, чтобы возыметь действие. При рН 5 нужно добавить намного больше ионов для изменения рН. Это одна из причин (помимо многих, о которых речь пойдет ниже) почему рН в питательном растворе нужно поддерживать на пониженном уровне.
Щелочность
Вода, которая на шкале рН находится в зоне основ, называется щелочной. Из-за схожести названий многие недопонимают разницу между водой с основным рН и щелочностью.
Может сложиться мнение, что все воды одинаковым образом реагируют на простые законы рН, но это не так. Вообще щелочность показывает совершенно иное свойство воды, чем шкала рН, а именно: насколько стабилен рН воды. Щелочность измеряется количеством кислоты, необходимой для доведения рН воды до нейтрального. Шкала имеет деления от 0 (чистая вода) до 5: низкая (0,5), низко-средняя (0,5 2), средневысокая (2 5), высокая (> 5). Единица измерения миллиэквивалент/литр (мэкв/л), и даже не пытайтесь в этом разбираться! При анализе воды эту величину часто выражают как эквивалентное содержание карбоната кальция. В гидропонике минимальный уровень активного буферного эффекта составляет около 20 мг/л карбоната кальция. Здесь возникает важное для нас понятие: буфер и буферное свойство. Буфер — это соединение, которое поддерживает стабильность рН, когда вы добавляете в раствор кислоту или основу. Иными словами, вам понадобится гораздо больше кислоты для снижения рН, если в воде много буферов. Разумеется, есть предел. Избыток кислоты превысит буферную способность раствора, но без буферов рН вашего питательного раствора будет неуправляемым. Чтобы понять, как работает буфер, нам придется перейти на язык науки. Большинство буферных свойств в естественных водах возникают, благодаря растворенным элементам, которые называются «карбонатами». Они действуют по правилам химии неорганического углерода (углерода, не связанного с органической молекулой). Они образуются, когда вещество, содержащее углерод, растворяется в воде. Это может быть просто углекислый газ или карбонизированный минерал, часто карбонат кальция, но и карбонат магния, карбонат калия, карбонат натрия и т.д.
Возьмем простейший пример:
Когда углекислый газ растворяется в воде, образуется угольная кислота:
СО2 + Н20 = Н2СО3 (карбонат)
Углекислый газ + вода = угольная кислота (карбонат)
Два водорода в Н2СО3 являются резервом ионов Н*. В зависимости от рН угольная кислота будет стабильной или лишится одного из водородов:
Н2СО3 = н+ + со32-
Угольная кислота = ион водорода + ион бикарбоната Реакция может и продолжаться:
НСО3- = Н* + СО3'-
Эти реакции происходят в зависимости от рН и в обоих направлениях (то есть, от СО3-2 к Н2СО3). Когда высвобождаются ионы Н*, они сопротивляются превращению раствора в основание; когда эти ионы снова захватываются, они сопротивляются подкислению. Очевидно, тем самым стабилизируется рН. К сожалению, карбонаты буферируют рН на уровне 7, что слишком высоко для гидропоники. Как составители питательных веществ, мы должны добавлять прочие буферы, чтобы сдвигать этот баланс в сторону рH 6.
Мы рассматривали пример углекислого газа, но прочие карбонаты реагируют аналогичным образом.
Для простоты я рассматривал здесь только карбонизированную щелочность. Буферным эффектом обладают и некоторые другие соединения. Для нас актуальны фосфаты, силикаты, нитраты и растворенный аммиак. Обсуждение их химических свойств заведет нас слишком далеко; просто нужно знать, что они играют роль, аналогичную карбонатам.
Жесткость
Жесткость указывает на количество растворенных в воде ионов кальция и магния. Когда в воде повышенное содержание кальция и магния, такую воду называют «жесткой водой». Такая вода образует белый налет на кастрюле, в которой кипятят воду. Такая вода сушит кожу и вредит ей, в такой воде не вспенивается мыло и т.д. Во множестве случаев содержание магния составляет ничтожную долю всех растворенных минералов, и из практических соображений им можно пренебречь. Среди многих растениеводов бытует заблуждение, будто высокий уровень рН есть верный признак жесткой воды. Даже при том, что действительно в большинстве жестких вод присутствует повышенный рН, прямой зависимости между рН и жесткостью нет. Более того, большинство городских вод имеют рН, который искусственно повышают, чтобы защитить трубы от коррозии. Как правило, нельзя полагаться на рН как на показатель жесткости воды. Можно обратиться в компанию, которая отвечает за ваше водоснабжение, чтобы они сделали анализ содержания минералов в вашей воде или определили степень жесткости. Жесткость выражается во многих разных единицах измерения; для наших целей годится мг/л, но в лабораторных анализах часто встречается и другая единица.
Кальций встречается нам в гораздо больших количествах, чем любой другой элемент, растворенный в воде. Растения нуждаются в весьма большом количестве этого элемента, так что проблемы возникают только когда его содержание чрезмерно увеличивается. Кальций обожают быстрорастущие однолетние растения, которым для полного счастья нужно 160 180 мг/л кальция. В продаже можно найти питательное вещество, рассчитанное для воды с высоким содержанием кальция - «питательное вещество для жесткой воды». Убедитесь при покупке в том, что продукт соответствует содержанию кальция в вашей воде. Ни в коем случае нельзя пользоваться смягчителем воды; последний заменит кальций на натрий и будет еще хуже! Вместо классического хлорида натрия в смягчителе воды можно при менять хлорид калия. В этом случае вы обмениваете кальций на калий, рискуя теперь уже переборщить с калием. Конечно, четкого разграничения между мягкой и жесткой водой нет. Черта проходит где-то около 70 мг/л. Если, допустим, содержание кальция в воде колеблется в пределах от 60 до 90 мг/л, то можно использовать питательное вещество, предназначенное для жесткой воды. Если выше 140 мг/л, то будет затруднительно пользоваться замкнутой системой, не прибегая к фильтрации.
Понятия рН, щелочность и жесткость очевидно сопряжены друг с другом. Элементы, отвечающие за жесткость, кальций и магний, зачастую растворены в виде карбонатов. Вода, просачиваясь сквозь почву, растворяет карбонаты кальция или магния (последний более подвержен растворению, чем первый). Таким образом, вода с повышенной жесткостью также зачастую содержит больше карбонатов и имеет высокий рН. Несмотря на такую взаимосвязь, все же не следует заблуждаться - эти явления относятся к разным свойствам. Например, можно добавить в воду кислоты. Тем самым изменится её рН, но не щелочность. (Карбонаты всего лишь примут другую форму.) Карбонаты могут происходить из карбонатов натрия или калия. Это буферирует воду (прибавит щелочности), но не прибавит жесткости.
Соленость
Соленость имеет мало общего с соленым привкусом во рту. Соленость показывает общее количество растворенных в воде солей. Она выражается в частях на миллион или электропроводимостью. Вообще единственный точный способ измерения количества солей в растворе - это выпаривание пробы воды и взвешивание сухого остатка. Это действие постоянно выполняется в лабораториях, но в реальной жизни заниматься этим скучновато. Чистая вода не проводит электричество. Она обладает почти бесконечной электрической сопротивляемостью. Когда в воде растворены соли, образующие ионы, в действие вступает электрический процесс, и электричество может проходить сквозь воду. Чем больше растворенных солей, тем больше поток электричества. Таким образом мы можем получить вполне ясное представление о совокупном количестве растворенных солей, измеряя насколько легко электрический ток проходит через раствор. Казалось бы, чего проще! Да. Ан нет! Мы не получаем четкого ответа, потому что не все растворенные соли проводят электричество равным образом. Не вдаваясь в подробности, скажем - не все ионы равны между собой. Некоторые соли даже в растворенном виде испытывают притяжение друг к другу, так что большая часть их электрического заряда тратится на эту связь, и измерительные приборы не регистрируют высокой проводимости. В результате при тестировании; растворов для цветоводства или плодоводства показания кондуктометров оказываются ниже реального содержания солей. Разница может составлять до 20%. Проводимость вегетативного раствора больше соответствует реальному содержанию солей. Вы также получаете представление о том, много или мало солей в растворе, но не каких конкретно. А жаль, потому что не у всех ионов судьба складывается одинаково. Некоторые, например калий, поглощаются очень быстро, а фосфор или кальций выпадают из раствора! Но вам... и вашим растениям придется с этим смириться. Всё, что вам известно о растворенных солях — это ориентировочные данные. Поэтому при покупке вам следует тщательно подбирать питательное вещество и удостоверяться, что оно хорошо приспособлено для гидропоники. Иначе, несбалансированное питательное вещество вызовет отложение солей в растворе и недостаточности. Проводимость также сильно отразится на поглощении воды растениями. Об этом речь пойдет ниже, но в целом: чем выше проводимость, тем выше концентрация солей, и тем труднее растениям впитывать воду. При некоторых концентрациях вода течет из растения в питательный раствор. Нетрудно представить, сколько продержатся эти растения, прежде чем завянут окончательно и бесповоротно!
Проводимость измеряется кондуктометром. Эти приборы встречаются в широком ценовом диапазоне - от доступных карманных до дорогостоящих лабораторных инструментов. Независимо от цены они хрупкие и требуют хорошего ухода. Внимательно ознакомьтесь с инструкциями, особенно по части обслуживания. Даже прибор, который содержат в хорошем состоянии, требует регулярной калибровки. Позаботьтесь, чтобы у вас под рукой всегда имелись нужные калибровочные растворы.
Понятия рН-фактора, щелочности, жесткости и проводимости из области теории, но разбираться в них необходимо, чтобы владеть ситуацией. Эти понятия помогут вам самостоятельно читать результаты анализа воды и понимать, всели в норме для выращивания или нужна фильтрация. Знание в сочетании с интуицией сделает вас хорошим растениеводом.
Большинство водных источников отвечают требованиям гидропонного выращивания. Если вы подключены к муниципальному водоснабжению, то вполне вероятно, вода пригодна для ваших целей. Бывают и заметные исключения, например самые распространенные из них, когда вода содержит натрий и в меньшей степени бор.
-Натрий в незначительных количествах необходим растениям, но по мере накопления он становится смертельным ядом. Такое хрупкое растение как салат-латук способно переносить 30 мг/л натрия. Более выносливое, быстро растущее растение выдержит около 200 мг/л, но при таком уровне вы не сможете эксплуатировать систему замкнутой циркуляции. Натрий поглощается растениями медленно и в малых количествах, поэтому он скапливается в замкнутых системах. Начальная концентрация для замкнутых систем не должна превышать 30 мг/л.
-Бор также является пищей растений в малых количествах (это одно из микро питательных веществ), но выше определенного уровня он вызывает в растениях токсичность. Это также медленно поглощаемый элемент, который может накапливаться в питательном растворе. Помимо этого, высокое содержание бора может сложным образом повлиять на поглощение других элементов. Сильное однолетнее растение способно усвоить до 2,0 мг/л, но во избежание накапливания бора в системе рециркуляции, содержание бора в воде не должно превышать 0,30 мг/л.
Фильтрация и очистка
Речь не о механической фильтрации, которая защищает насос от остатков растений, а распылители воды - от засорения. Речь об удалении из воды нежелательных растворенных элементов, что гораздо более сложная задача! Конечно, механическая фильтрация всегда обязательна. На входном патрубке насоса нужен механический фильтр. Обычно это просто синтетическая губка. Вам даже может понадобиться сетчатый фильтр на питающей магистрали вашей системы. Если у вас муниципальное водоснабжение, то, как правило, фильтрация не нужна. Исключение составляют воды с высоким содержанием рассмотренных выше элементов. Фильтрация чаще бывает нужна, если вода подается из колодца или любого другого природного источника. В этом случае придется ограждать себя от патогенов и химических загрязнителей. Прежде чем вы сможете использовать эту воду для выращивания растений, следует отправить пробу воды на полный анализ. Проверьте минеральный состав, а также убедитесь в отсутствии патогенов или загрязняющих веществ (пестицидов и гербицидов, остаточных углеводородов, помимо всего прочего). Дешевле всего обращаться в сельскохозяйственные лаборатории, которые существуют повсеместно.
Прежде чем применять какой бы то ни было тип фильтрации, убедитесь, нужна ли она вам вообще! Мне часто встречаются люди, которые отфильтровывают из воды кальций..., а потом вносят его обратно с питательными веществами!
Если вам все же нужно фильтрование, в закрытых помещениях выбор вари антов невелик и ни один из них не лишен недостатков. Растворенные ионы застревают между молекулами воды, будучи полностью ими окружены, и не могут высвободиться. В случае небольшой комнатной установки только один фильтр удалит из воды все растворенные вещества - фильтр обратного осмоса. Чистота полученной воды колеблется от 90% до 99% в самых эффективных системах.
Обратный осмос (ОС)
Здесь будет уместно ввести такое существенное понятие как осмос, который играет жизненно важную роль в поглощении питательных веществ растениями и еще большую - в гидропонике. Вот определение осмоса, данное Принстонским университетом:
«Осмос представляет собой диффузию молекул сквозь полупроницаемую мембрану из места с более высокой концентрации в место с более низкой концентрацией до тех пор, пока концентрации по обе стороны мембраны не станут равными».
На первый взгляд данное определение может показаться несколько мудреным! Здесь под концентрацией подразумевается концентрация воды. Очевидно, что если по одну сторону мембраны больше растворенных веществ, то воды меньше (растворенные вещества занимают её место), значит, вода потечет в эту сторону - от высокой концентрации воды к низкой концентрации веды - до тех пор, пока не установится равновесие, и концентрация воды станет одинаковой по обе стороны. Для наглядности можно взглянуть на 'то явление иначе: вода потечет в сторону мембраны с более высокой концентрацией растворенных веществ до установления равновесия. Сила, толкающая воду сквозь мембрану, называется осмотическим давлением. Следует усвоить, что, находясь по обе стороны полупроницаемой мембраны, вода всегда стремится к достижению одной и той же концентрации. Такая мембрана пропускает растворитель (в нашем случае воду), но задерживает растворенные в нем элементы. Стенки клеток растений или животных - яркий -гример полупроницаемой мембраны. Осмос - одно из средств транспорта воды и питательных веществ внутри растений или деревьев. Этим способом клетка также регулирует внутреннее давление.
Обратный осмос работает с точностью до наоборот: вода принудительно нагнетается через мембрану под высоким давлением, оставляя все позади. В этом случае вода прогоняется сквозь мембрану независимо от осмотического принципа, рассмотренного выше. Эффективность системы зависит от качества мембраны и давления - чем больше, тем лучше. Вот, представим для наглядности: бытовая система обратного осмоса под раковиной должна работать под давлением 4-5 бар. Для очистки воды, содержащей 1100 мг/л растворенных веществ (типичная концентрация питательного раствора), нужно около 13 бар. Для очистки морской воды нужно гораздо больше - около 55 бар.
Казалось бы, отменный способ получения чистой воды, но при получении 1 литра чистой воды теряются 2-4 литра воды (в зависимости от давления). Конечно, эту воду можно использовать для хозяйственных нужд во дворе... если он у вас есть. К тому же мембраны хрупки: они не выдерживают такие «грубые» элементы как фосфор. Они чувствительны к хлору. Элементы, отвечающие за жесткость, кальций и магний, скапливаются на мембране и засоряют её. Система фильтрации обратного осмоса зачастую оснащена фильтром грубой очистки для улавливания крупных частиц, угольным фильтром для хлора и иногда даже смягчителем воды для предварительной очистки, если содержание кальция высоко. Несмотря на эти недостатки, бывают случаи, когда ОС фильтрация - единственный выход из положения, если хочешь получить нормальную воду для гидропонной системы. Будьте бдительны: одна только ОС вода не годится для гидропоники. Чистая вода не обладает буферными свойствами. При малейшей добавке солей рН поскачет вверх-вниз. И вода также станет вступать в реакцию со всем, с чем она будет соприкасаться. Это очень отрицательно скажется на корнях. Самый распространенный источник неудач — это применение ОС фильтрации. По понятным причинам первое, что приходит в голову растениеводу, это то, что чистая вода - лучше всего, но вопреки интуиции — это не так! Для обретения стабильности и получения квази-идеальной воды можно примешать около 20% водопроводной воды в зависимости от её состава. Или же можно кондиционировать воду, отфильтрованную с помощью ОС, добавив гомеопатическую дозу карбоната калия для повышения рН, а затем немного кислоты, желательно фосфорной с буферным свойством. Внесите столько кислоты, сколько нужно до доведения рН до 6,0. И вот вы - счастливый обладатель «идеальной» воды для ваших растений. Остается заправить её питательными веществами, но об этом речь пойдет ниже.
Есть и другие типы фильтрации, но ни один из них не избавит вас от растворенных минералов. Однако и они обладают кое какими преимуществами, когда проблема не в минерализации, а вы хотите избавиться от всех нежелательных загрязняющих веществ, встречающихся в муниципальной воде в наши дни - хлора, хлораминов, остаточных пестицидов, антибиотиков и т.п. Я освещу эту тему вкратце.
Ультрафиолетовый (УФ) фильтр
Раствор питательного вещества проходит сквозь камеру, в которой он подвергается УФ излучению. Этот фильтр изначально предназначался для уничтожения патогенов в аквариумах. Данный фильтр не удаляет загрязняющие вещества: он воздействует только на живые организмы. Он годится только для контроля над патогенами. У него два главных недостатка с точки зрения гидропоники. Для того, чтобы УФ фильтр оказывал должное воздействие, скорость течения раствора должна быть медленнее той скорости, которая оптимальна для оксигенации; а еще ультрафиолет разлагает хелаты, большие органические молекулы, удерживающие в растворе железо (в добротных гидропонных питательных веществах - еще и другие микроэлементы). И конечно же, нельзя использовать ультрафиолет, если на вас работают полезные микроорганизмы. УФ-излучение убивает и друзей, и врагов без разбору.
Песочный фильтр
Есть отличные фильтры, задерживающие сор и даже патогены. Они могут создавать благоприятную среду для процветания полезных микроорганизмов. Они разлагают органику и борются с патогенными грибками. К сожалению, они замедляют поток питательного раствора до такой степени, что их применение становится нецелесообразным в динамичной гидропонной системе. Единственный способ использования такого фильтра - в выделенном контуре, отдельно от циркуляции питательного раствора с приданным насосом, который перегоняет питательный раствор из бака на фильтр и обратно в бак! В этом случае он будет функционировать как биофильтр.

Биофильтр
Биофильтр предназначен главным образом для обеспечения среды, в которой микроорганизмы могут расти в большом количестве, поддерживать здоровье питательного раствора, привносить больше питательных веществ, разлагая мертвую органику и выпуская в питательный раствор множество аминокислот, полезных фитогормонов и ядов для борьбы с патогенными грибками. Этот фильтр также лучше всего применять с выделенным насосом вне основной циркуляции. Биофильтры снабжены синтетической губкой, функционирующей как предварительный фильтр, захватывающий сор, который микробы на месте подвергнут разложению. Затем, в фильтре есть пространство, наполненное субстратом, которое функционирует как среда обитания и размножения для колоний бактерий и грибков. Этот тип фильтра полезен для разложения мертвой растительной массы, для внесения микроорганизмов в питательный раствор и для биопоники.
Фильтр из активированного угля
Уголь активируется для создания в его структуре миллионов микроскопических пор. Он может быть изготовлен из любого углеродистого материала, например древесины, угля и т.д., но исходным материалом часто служат скорлупа или волокна кокосового ореха благодаря их доступности и дешевизне. Первый процесс - превращение скорлупы в древесный уголь. Это делается также, как древесный уголь в ямах или печах. Затем уголь активируют, пропуская через него водяной пар при 1000°С. В результате получается исключительно пористый материал с большой площадью поверхности (около 1км"/кг, 1000 м2/грамм!) с бесчисленными связками. Когда сквозь него проходит вода, то многие примеси застревают в этих связках. Они не просто физически задерживаются, а связываются с углеродом крепкими химическими связями (абсорбируются, говоря научным языком). Угольные фильтры хорошо улавливают «органику», в структуру которой входит углерод. Не все активированные угли одинаковы; это зависит от исходного материала и технологического процесса. Они могут иметь форму порошка или гранул; выбирайте гранулы. Эти фильтры главным образом полезны в связке с другим типом фильтрации. Например, их применяют в системах обратного осмоса как предварительные фильтры, чем повышают срок эксплуатации мембран. И, конечно, они применяются в качестве воздушных фильтров. Углеродные фильтры имеют срок эксплуатации, который зависит от загрязняющих примесей в воде, но рано или поздно угольный картридж перенасытится, и его придется менять. Уголь может быть реактивирован, но этот процесс в домашних условиях недоступен.
Керамические фильтры
Они испещрены мельчайшими порами. Если порыдостагают0,45 микрона, то вода, проходящая сквозь них, будет стерильна, а если меньше 1 микрона, то она будет биологически безопасна для использования. Этот тип фильтра удаляет любые формы микробов, начиная самими микробами и кончая их яйцами, а также невидимые частицы грязи во взвесях. На пару с углеродным фильтром они просто бесподобны. Они забирают из воды все нежелательное, оставляя только минералы, которыми будет питаться растение. Хорошей маркой является «Дойкой». Единственная проблема с ними — это низкая скорость потока. Они медлительны, поэтому приходится планировать заранее, если собираетесь наполнять бак, и нужно время для прохождения воды через фильтры.
Есть и другие способы фильтрования или очистки воды, но ни один, кроме описанных мной, не годится для культивации в комнатных условиях.
Питательные вещества
Теперь, когда у нас есть качественная вода, внесем в нее питательные вещества. Они те же, что и в почве. Независимо от того, произрастают ли растения на инертном субстрате или в грунте, они питаются теми же элементами. Вообще даже в почве растения впитывают свои питательные вещества только тогда, когда последние растворены в воде в виде ионов. Здесь я собираюсь ввести важное понятие для понимания разницы между органическими (биологическими, растительными, как вам будет угодно) и минеральными питательными веществами (химическими, если вам так удобнее). В почве минеральные элементы, необходимые растениям, находятся в двух состояниях - в связанном состоянии, образуя камни, породу или грунт, либо в виде комплексных органических молекул. Органические молекулы образуются в результате разложения некогда живого организма: они все были частью некоего существа. Это большие молекулы. Они связаны электрическими зарядами с мельчайшими частичками почвы. Они состоят из углерода, водорода, атомов минералов и металлов. Вот из этого из образуется слой гумуса. Этот слой гумуса кишмя кишит жизнью: бактериями, грибками, нематодами, насекомыми, членистоногими, червями и т.д. Некоторые из этой живности питаются органикой, поглощая углеродные составляющие молекул в качестве источника энергии, и высвобождают содержащиеся в молекулах ионы минералов и металлов. Эти элементы растворяются в почвенной воде, а затем поглощаются растениями. Если этого не происходит, они просачиваются в нижние грунтовые воды, так как их свойства не позволяют им удерживаться в почве. Когда минералы образуют комплексы с органическими молекулами, тогда они и удерживаются в корневой зоне. Разумеется, я всего лишь упрощенно излагаю суть очень сложного процесса. И органические молекулы, и минералы неодинаковы, но общий принцип процессов такой.
Второй источник питания для растений-порода, грунт. Последний, судя по определению, весьма стойкий материал, но под воздействием органических кислот, выделенных растениями и микроорганизмами, при содействии кислотных дождей часть его поверхностных элементов растворяется и становится добычей растений. И в этом случае, если эти элементы не поглощаются, то оказываются в нижних горизонтах почвы или в грунтовых водах. Так подземные воды насыщаются минералами.
В итоге - каков бы ни был источник, растения поглощают растворенные ионы минералов и металлов. То же происходит в гидропонной культивации мы: растворяем минеральные соли, которые непосредственно готовы к употреблению растениями. Итак:
- органическое питательное вещество приносит вашим растениям питательные вещества в виде комплексов или порошкообразной породы. Эти питательные вещества не выщелачиваются дождевой водой и образуют питательный запас в почве, который должен разложиться, чтобы стать доступным для растений. Они становятся доступными только посредством разложения микроорганизмами.
- Растворы минеральных питательных веществ состоят из
растворенных солей и непосредственно усваиваются растениями, но не способны связываться с почвой. Это упрощенный взгляд, но можно сказать, что органические питательные вещества будут действовать медленно, а минеральные соли дадут мгновенную реакцию.
Применение минеральных солей в открытом поле вызывает большие нарекания, и не без причины. Такова тенденция в нашем сельском хозяйстве уже с полсотни лет, что в наши дни создает серьезные проблемы с окружающей средой, приводит к истощению микроорганизмов в поле, без которых нельзя поддерживать почву в хорошей форме и развивать устойчивое сельское хозяйство. Можно вполне обоснованно говорить отом, что применение минеральных солей контрпродуктивно и должно быть сокращено, а то и прекращено в открытом грунте. Вредны не соли, а способы их применения. Достаточно заключить те же соли в замкнутую гидропонную систему, как они не только становятся безвредными, а превращаются в лучших друзей растениевода.
В каких элементах нуждается растение? Важно усвоить, что если элемент отсутствует, то это вызовет недостаточность данного элемента, и никакой другой элемент не сможет полноценно его заменить. Казалось бы, простое правило, но в реальной жизни граница просматривается не так четко, и некоторые элементы и поныне пребывают в серой зоне. Поэтому количество жизненно важных элементов у разных авторов зачастую разное. Некоторые элементы переносятся газами и водой, например углерод, водород и кислород. Некоторые подразделяются на три категории (иногда две, но я предпочитаю именно эту классификацию) согласно количеству, необходимому для растений.
Макроэлементы: азот, калий, фосфор необходимы в больших количествах; в этой последовательности первым идет азот.
Вторичные питательные вещества: кальций, магний, сера. Как подсказывает наименование, этих элементов нужно меньше, новее равно в больших количествах, чем микроэлементов;
Микроэлементы: железо, медь, цинк, марганец, бор, молибден, хлор. Железо нужно в большем количестве, чем прочие; молибден нужен в гораздо меньшем количестве. Вообще эти элементы не входят в структуру растения, а скорее участвуют в энзимных реакциях; поэтому их требуется совсем мало.
Эти 13 элементов плюс 3 структурных (кислород, водород, углерод) - итого 16.

К ним следует добавить элементы, иногда именуемые существенными, а иногда нет. Такие элементы как кобальт или кремнезем - очень вероятные кандидаты в существенные элементы. Остальные, может, и не существенные, но играют определенную роль в питании растения, например никель, натрий, селен, ванадий. Как видим, граница между существенными элементами размыта!
Таблица: роль каждого элемента
Углерод (С). Формирует становой хребет растения, как у всех прочих живых существ. В виде углеводов углерод аккумулирует в растениях энергию.
Водород(Н). Входит во все органические молекулы, необходим для построения сахаров. Также используется во многих реакциях с участием электрических зарядов и при поглощении некоторых элементов.
Кислород (О2). Используется в клеточном дыхании для преобразования сахаров в энергию.
Азот (N). Элемент, имеющийся в растениях в самом большом изобилии. Является компонентом хлорофилла, аминокислот и многих прочих важных органических молекул. Важный компонент всех белков. Играет ключевую роль в росте стебля и листьев.
Калий (К). Второй по изобилию элемент. Исполняет иную функцию - кофактора в энзимной реакции и котранспорта, но его главная роль - регулирование движения воды в растениях. Он придает растениям полноту и пышность, повышает морозоустойчивость растений.
Фосфор (Р). Центр энергетических молекул, АТФ (аденозина трифосфат) и АДФ (аденозина дифосфат). Накапливает световую энергию после её преобразования в химическую энергию. (Подвиг!) Регулирует активность белков и входит в состав клеточных стенок. Играет важную роль в цветении растений, в прорастании семян и росте корней.
Кальций (Са). Входит в состав клеточных стенок. Регулирует (ограничивает) поглощение других элементов.
Сера (S). Молекула вкуса и запаха. Также встречается в защитном механизме и в двух аминокислотах. Составной элемент хлоропластов.
Железо (Fе). Играет важную роль в синтезе хлорофилла (но не входит в его структуру). Также является коэнзимом.
Медь (Си). Компонент энзимов, но также используется при построении клеточных стенок. Наибольшая концентрация в корнях.
Цинк (Zn). Активатор энзимов. Также важен при метаболизме углеводов. Играет роль в удлинении стебля.
Магний (Мg). Занимает центральное положение в молекулах хлорофилла, а также функционирует как коэнзим. Является составным элементом хлорофилла.
Марганец (Мп). Важная составляющая энзимной и антиоксидантной деятельности. Также используется для построения хлоропластов, вдыхании, в метаболизме азота.
Молибден (Мо). Участвует в процессе азотофиксации. Коэнзимный фактор при построении аминокислот.
Бор (В). Один из компонентов клеточных стенок. Он также играет роль в делении клеток и в транспорте сахара.
Хлор (Сl). Участвует в реакциях фотосинтеза. Используется для регулирования осмотического давления и ионного баланса.
Натрий (Na). Может замещать калий (в редких случаях). Выполняет ряд метаболических функций - либо самостоятельно, либо замещает другой элемент.
Никель (Ni). Полезен для поглощения мочевины. (Необходим для энзимной уреазы). Также способствует поглощению железа.
Кобальт (Со). Играет важную роль только в растениях семейства бобовых для азотофиксации.
Кремний (Si). В качестве компонента клеточных стенок укрепляет стебель и листья. Повышает засухоустойчивость и жароустойчивость растений (что желательно при выращивании растений в помещении в слишком знойной среде).
Растение снабжается большинством элементов в одной форме в виде простого минерала. Заметным исключением является азот, и форма, в которой азот подается, имеет большое влияние на рост растения. Азот может происходить из 3 источников: нитрат N03, самый распространенный в гидропонных растворах, аммиак NH3 и мочевина СО (NH2), органическая форма, что содержится в коровьей моче (но не в человеческой!). Будучи самым дешевым источником азота, мочевина широко применяется в полеводстве, но это органический элемент, который должен разложиться, чтобы стать доступным для растений. Следовательно, он малопригоден в гидропонике, если только это не система с замкнутым контуром. Мочевина пользуется дурной славой из-за токсичной примеси - биурета, который иногда в ней встречается.
Аммиак почти незаменимый компонент формулы - единственный элемент, способный понижать рН питательного раствора. Растения безотказно отделяют водород (Н+). Аммиак способствует стабильности раствора.
Взаимодействия и химические реакции, происходящие в присутствии нитрата NOз) или аммиака (NH4), слишком сложны, чтобы их подробно разбирать здесь. Достаточно просто знать, что имеется максимальная доля NH4, которая может быть использована. Избыток может приводить к последствиям - от замедления роста до токсичности. Какое должно быть процентное соотношение NH4 к NO3 неясно, и не все с ним соглашаются. Конечно, зависит от культуры. Некоторые предпочитают вообще не применять NH4. По своему опыту могу утверждать, что NH4/ NO3 в соотношении 20/80 дает хорошие результаты. Конечно, общий уровень азота в растворе также важен. Высокое содержание ионов нитрата (NO3) помешает поглощению железа и в результате вызовет железный хлороз, даже если количество железа в растворе оптимально.
Фосфор - один из элементов, за которым нужен глаз да глаз. Из-за притяжения фосфора к заряженным поверхностям он частично захватывается субстратом. Это случается за очень короткий промежуток времени и приводит к очень низкому уровню фосфора вскоре после подачи нового питательного вещества. Фосфор реагирует больше всего с элементами из раствора, особенно с кальцием, образуя фосфат кальция. Из него состоит большая часть отложений белого цвета на системах, субстрате или трубах.
Аналогичным образом и цинк (Zn) очень сильно притягивается к заряженным поверхностям. Это притяжение усиливается с рН вплоть до того, что при высоком рН может наблюдаться недостаточность цинка.
Главное затруднение при выработке формулы питательного вещества состоит в том, что макро- и вторичные элементы не вносятся в одиночку, а всегда парами, как любая соль. Когда нужно внедрить какой-нибудь один элемент, то фактически вы вводите в раствор два элемента. Например, азот в виде нитрата калия, нитрата аммиака, нитрата кальция и т. п... В случае калия можете применять сульфат калия, моно- или дифосфат калия и т. д... Можно вносить некоторые элементы в виде кислот (N, P), но вас тут же ограничит в этом показатель рН.
С микроэлементами дело обстоит иначе. Их можно вносить в виде сульфатов или хелатов. Термин «хелат» происходит от греческого слова «клешня», что наглядно описывает эти молекулы. Это большие искусственные органические молекулы, которые захватывают своими клешнями микроэлементы. Когда запас этого элемента в растворе истощается, клешня разжимается и выпускает его. Хелаты - замечательная штука, потому что они не допускают передозировки микроэлементов в ваших растениях. При выборе питательной смеси важно выбрать смесь с хелатированными микроэлементами. Хелаты - самый дорогостоящий материал в питательном растворе, поэтому многие производители вместо него предпочитают иметь дело с сульфатами. Только с помощью хелатов железа можно какое-то время надежно удерживать в растворе железо, но в случае прочих микроэлементов используются сульфаты. Они привносят элементы, но совершенно лишены буферного свойства, и вы почувствуете эту разницу при употреблении в пищу конечного продукта. Металлический привкус, возможно знакомый вам, происходит из отложений микроэлементов, чаще всего меди.
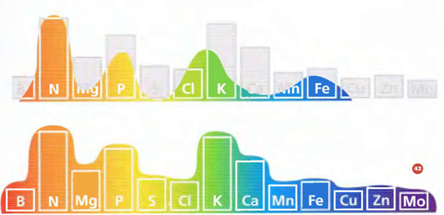
Необходимо понять, в чем разница между почвенными и гидропонными питательными веществами.
Как видно из диаграммы, почвенное питательное вещество не охватывает все потребности растений. Когда производитель составляет формулу почвенного питательного вещества, он принимает во внимание вещества, уже находящиеся в почве, и вносит элементы в дополнение к ним. Гидропонное питательное вещество позволяет вам выращивать растения в воде. Очевидно, что должны быть удовлетворены все потребности растений. Формула должна быть всеобъемлющей и хорошо сбалансированной. Почвенные питательные вещества для гидропоники не годятся. Зато можно вполне использовать гидропонные питательные вещества в почве, где они дают даже лучшие результаты, чем почвенные питательные вещества. Это объясняется тем, что даже при наличии микроэлементов они плохо растворяются, зачастую блокируясь различными механизмами, вызывая у растений недостаточности.
Как только вы выберете, какое питательное вещество задать вашим растениям - минеральное или органическое, вам еще предстоит решить, какое из них окупит понесенные затраты. Вот вы стоите в магазине и смотрите на различные марки и не знаете, какую выбрать. Вам поможет этикетка на товаре, хотя в нашем деле некоторые этикетки выглядят весьма замысловато! В Приложении 2 я разъясню, какую информацию можно почерпнуть из этикетки, на что следует обращать внимание и чего остерегаться.